Cicloesano
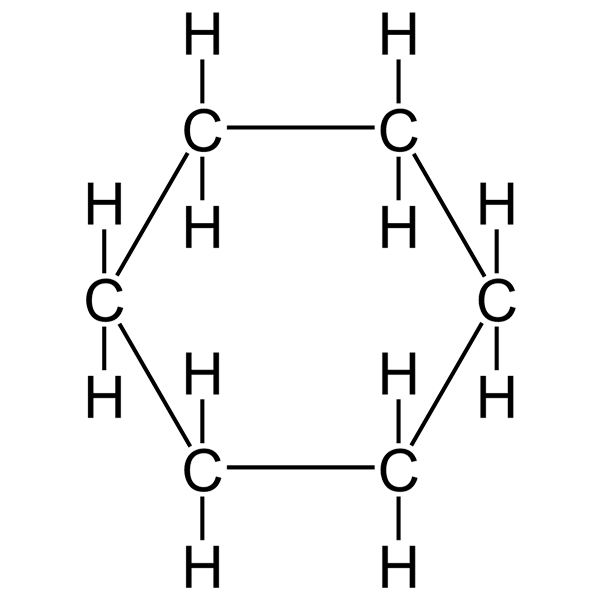
Il cicloesano è un particolare cicloalcano caratterizzato da interessanti caratteristiche, derivanti dalla sua formula chimica e conformazione. La formula del cicloesano è C6H12: questo significa che ad ogni atomo di carbonio sono legati due atomi di idrogeno.
1000 in stock
Il cicloesano è un particolare cicloalcano caratterizzato da interessanti caratteristiche, derivanti dalla sua formula chimica e conformazione. La formula del cicloesano è C6H12: questo significa che ad ogni atomo di carbonio sono legati due atomi di idrogeno.
La forma del Cicloesano
Quando si schematizza una molecola di cicloesano solitamente si disegna un esagono, ossia con una figura geometrica regolare caratterizzata da angoli di 120°. Questa rappresentazione grafica può fare pensare che la molecola di cicloesano sia planare, ossia che tutti gli atomi siano contenuti sullo stesso piano. In realtà non è così, ma la molecola ha una forma ondulata, detta anche a sedia, con gli atomi di carbonio disposti su livelli differenti di piano.
Gli angoli che si creano tra gli atomi di carbonio, quindi, sono quelli tipici del tetraedro. Il carbonio del cicloesano, infatti, presenta un'ibridazione sp3 e questo ne rende impossibile la disposizione planare. Tuttavia, la scoperta dell'effettiva disposizione degli atomi all'interno di questa molecola ciclica non è stata né semplice né casuale, ma frutto di una lunga ricerca che ha portato il chimico Odd Hassel a ricevere il Premio Nobel per la chimica nel 1969.
Conformazione molecolare
La conformazione a sedia deriva da una necessità energetica ben precisa: essa, infatti, rappresenta quella meno dispendiosa dal punto di vista energetico e, pertanto, è la più conveniente. Questa struttura molecolare permette anche di distinguere meglio i diversi atomi di idrogeno che si legano al carbonio, che vengono suddivisi in idrogeni assiali ed equatoriali.
Gli idrogeni assiali sono disposti in maniera parallela tra di loro e all'asse di simmetria del cicloesano. Tuttavia non sono disposti tutti nello stesso piano orizzontale ma si può dire che alcuni sono disposti al di sopra e altri al di sotto del piano. La disposizione è alternata e prevede quindi che uno sia posizionato al di sopra del piano orizzontale e uno al di sotto e così via.
Gli idrogeni equatoriali sono posizionati invece in maniera opposta rispetto a quelli assiali: pertanto, se quelli assiali si trovano posizionati al di sopra del piano orizzontale, quelli equatoriali saranno al di sotto. Tuttavia, la direzione degli idrogeni equatoriali non sarà parallela a quella dell'asse della molecola, ma leggermente inclinata rispetto al piano orizzontale.
Altre conformazioni del Cicloesano
La conformazione a sedia della molecola non è l'unica possibile, ma quella energeticamente più conveniente. Esiste tuttavia un'altra conformazione, anche essa in grado di garantire una buona convenienza energetica, ossia la cosiddetta conformazione a barca. Questa forma molecolare può coesistere in equilibrio con quella a sedia in particolari condizioni di temperatura. La principale differenza tra le due conformazioni sta nel cambiamento di ruolo tra gli idrogeni assiali e quelli equatoriali. Gli idrogeni assiali della molecola a sedia, infatti, diventano quelli equatoriali nella conformazione a barca e viceversa.
Quando un idrogeno viene sostituito da altri elementi la forma più stabile è invece quella a sedia.
Un'altra importante differenza tra le due conformazioni è la rigidità di struttura. La forma a sedia, infatti, presenta una struttura molto rigida, in cui non sono presenti tensioni. La forma a barca, invece, presenta una struttura in grado di flettersi, creando delle forme twisted, ossia intrecciate.
Il motivo per cui le due forme possono coesistere ed essere convertibili l'una con l'altra è sempre di tipo energetico. La quantità di energia necessaria per il passaggio dalla conformazione a sedia a quella a barca è infatti molto bassa, ossia pari a 11 kcal/mol.
Per questo motivo il passaggio tra le due forme può avvenire anche a temperatura ambiente. La velocità di conversione porta tuttavia a un piccolo problema, ossia alla difficoltà nell'isolare le due forme con le tecniche di separazione grossolane, come la distillazione frazionata.








