Piridina
Il principale utilizzo della piridina è come solvente polare, basico a bassa reattività nella condensazione di Knoevenagel. La piridina deuterata invece viene impiegata come solvente per la spettroscopia NMR.
Proprietà e caratteristiche della piridina
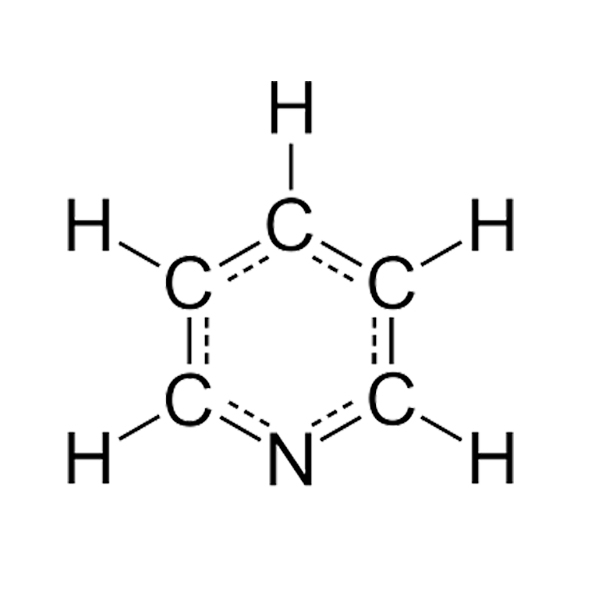
La piridina è un eterociclo azotato aromatico a 6 termini con formula C5H5N appartenente al gruppo delle azine. Gli eterociclici sono dei composti ciclici in cui uno o più atomi dell'anello vengono sostituiti da un altro atomo, definito eteroatomo; la piridina ha un sistema ciclico a 6 elettroni π simile a quello del sistema benzenico con un'unica differenza che la densità elettronica è maggiore a livello dell'eteroatomo N. Questa caratteristica della piridina le conferisce una particolare reattività e delle diverse caratteristiche acido-base.
La piridina ha una temperatura di fusione di -42°C, una temperatura di ebollizione pari a 115 °C una densità di 0,98 g/cm³. La piridina è priva di color e si caratterizza per un forte odore a tratti disgustoso, è infiammabile e può essere anche irritante e tossica.
La piridina si presenta come un esagono quasi regolare con strutturare planare con la delocalizzazione degli elettroni sopra e sotto il pian, una caratteristica tipica degli eterociclici aromatici. L'atomo di azoto partecipa al sistema aromatico con un elettrone spaiato; il suo doppietto elettronico non condiviso giace pertanto sul piano della molecola.
Come si comporta la piridina
La piridina si comporta sia da base che da nucleofilo, grazie alla disponibilità della coppia di elettroni solitaria, ma dato che tale coppia risiede in un orbitale sp² con maggiore carattere s rispetto ad sp³, la sua basicità è notevolmente inferiore rispetto a quella delle ammine alifatiche. Se si è in presenza invece di un composto acido la piridina lega a sé uno ione H+ per formare il catione piridinio. La piridina ha un carattere debolmente basico e addiziona acidi forti per formare sali cristallizzati. I sali formati dalla piridina vengono chiamati sali di piridinio: cloruro di piridinio o cloridrato di piridina.
Chimica della piridina
Il quadro generale di risonanza della piridina è molto simile a quello del nitrobenzene, di conseguenza non genera alcuna reazione di sostituzione di Friedel e Crafts. In presenza di reagenti nucleofili molto forti, la piridina reagisce diversamente rispetto al benzene e al pirrolo, così come è stato dimostrato dalla reazione di Chichibabin; in questa reazione di sostituzione nucleofila aromatica "atipica" si introduce un gruppo amminico della piridina e per azione della sodioammide si ottiene la 2-ammino-piridina.
La sintesi della piridina
Inizialmente la piridina veniva estratta industrialmente dal catrame di carbon fossile, ma questo processo risultava laborioso e quasi inefficiente, visto che si riusciva a sintetizzare solo lo 0,1% di piridina, per questo si è soliti usare la reazione di Chichibabin: attraverso una reazione di condensazione di aldeidi, chetoni, composti carbonilici α, β-insaturi con ammoniaca o derivati di ammoniaca. Tra gli altri metodi utilizzati per sintetizzare la piridina troviamo anche la reazione dell'acroleina con ammoniaca in presenza di aria. Tra i derivati della piridina troviamo anche alcune sostanze naturali come l'acido nicotinico e la nicotina, mentre altri si ottengono saturando i doppi legami del nucleo: esaidropiridina o piperidina.
Usi della piridina
Il principale utilizzo della piridina è come solvente polare, basico a bassa reattività nella condensazione di Knoevenagel. La piridina deuterata invece viene impiegata come solvente per la spettroscopia NMR. La piridina serve anche come denaturante per l'alcool etilico e per le miscele antigelo. La piridina è anche il composto di partenza per la preparazione di fungicidi a base di piritione.








